細菌を使って、人に役立つタンパク質を作らせた場合、細胞内で作られたタンパク質を細胞外に分泌させることで、目的のタンパク質を効率よく回収することが可能となります。しかしながら、通常、細菌などの生きている細胞は細胞膜に包まれているため、たとえ目的のタンパク質を作った(作らせた)としても細胞の外にでてきません。このため、細胞の外で働くタンパク質は細胞膜に存在する何らかの仕組みで、細胞膜を透過し細胞の外に分泌されると考えられます。この時に働くFtsYと呼ばれるタンパク質は、大腸菌を含めていろいろな生物で細胞膜や小胞体膜と相互作用し、目的のタンパク質を細胞外に出すための機能に関与することが知られています。
そこで、宇都宮大学バイオサイエンス教育研究センターの前田勇准教授(農学部兼任)らは、医薬品等の産生に利用されている放線菌の一種について、このFtsYタンパク質と細胞内で作られたタンパク質の分泌との関わりを解析しました。この結果、FtsYタンパク質の末端に存在する34個のアミノ酸がタンパク質の分泌に重要な働きを担っている事が明らかとなりました。
この結果は、放線菌のFtsYタンパク質と細胞膜とが大腸菌の場合とは異なる様式で結合していることを示唆しており、今後、放線菌を使って医薬品などを産生させる場合にその分泌効率向上に役立つと期待されています。
この研究成果は、ヨーロッパ微生物学会の学術誌FEMS Microbiology Letters(287巻1号)に掲載される予定です。
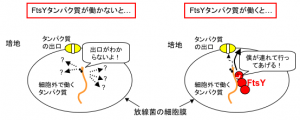
図1:有用な組み換えタンパク質を微生物に作らせる場合に は、タンパク質を培地中に分泌させる方が菌体内に留めさせておくよりも回収や精製が容易になります。研究により、産業上有用な微生物である放線菌において、分泌タンパク質を分泌装置へと導く役割を持つFtsYタンパク質の、細胞膜との結合領域に関する知見が得られました。
研究の背景と目的
グラム陰性細菌である大腸菌の細胞は細胞膜(内膜)と外膜の2種類の膜に包まれています。タンパク質の細胞膜透過の機構やFtsYの機能は大腸菌で最も良く研究されており、かなり詳細な部分が明らかになっています。しかしながら、細胞が2重の膜で包まれる構造から、細胞内で生産させた組み換えタンパク質を培地へと分泌させるためには、タンパク質に2種類の膜を透過させるという難しさがつきまといます。一方、グラム陽性細菌である放線菌は細胞膜のみの1種類の膜で細胞が包まれており、細胞内で生産させた組み換えタンパク質をグラム陰性細菌よりも容易に培地へと分泌させることができます。過去には千葉県にあるヒゲタ醤油が、羊毛刈りの省力化に役立つ上皮細胞増殖因子と呼ばれるタンパク質を、グラム陽性細菌である枯草菌を用いて培地に分泌させ生産する技術でコストの低減化に成功しています。
しかしながら、グラム陽性細菌においてはタンパク質の細胞膜透過機構はほとんど解明されていません。この研究ではグラム陽性細菌の中でも産業上、重要な位置付けである放線菌において、タンパク質の細胞膜透過機構を解明することを目的に、透過機構に関わるタンパク質の1つであるFtsYの細胞膜との相互作用領域を明らかにするための試験を行いました。
研究の内容
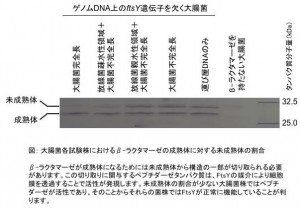
試験のために、放線菌のftsY遺伝子の様々な部分と、細胞膜との結合領域を欠く不完全な大腸菌FtsYの遺伝子をつなげた人工ftsY遺伝子を作成しました。その中の代表的なものを図に示します。そして、ゲノムDNA上のftsY遺伝子を欠く大腸菌に、これらの人工遺伝子をそれぞれ導入することで、人工ftsY遺伝子の機能が正常かどうかを調べました。細胞膜との結合領域を欠く不完全な大腸菌FtsYは細胞膜と結合できないため、これをコードする遺伝子を導入しただけではタンパク質は分泌されません。この不完全な遺伝子に放線菌の遺伝子をつなげることで、その放線菌遺伝子が細胞膜との結合能をもつタンパク質をコードするかどうかを調べることができます。
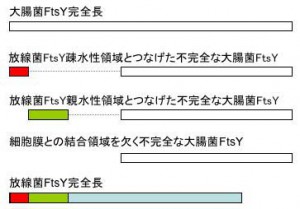
図2:試験のために設計された、放線菌FtsYと大腸菌FtsYの融合タンパク質 「細胞膜との結合領域を欠く不完全な大腸菌FtsY」は細胞膜と結合できないため、これをコードする遺伝子を導入しただけではタンパク質は分泌されません。この遺伝子に放線菌の遺伝子をつなげることで、その放線菌遺伝子が細胞膜との結合能をもつタンパク質をコードするかどうかを調べることができます。
FtsYタンパク質の機能を確認する方法(ここでは細胞膜との結合能を確認する方法)の1つとして、β-ラクタマーゼの成熟体と未成熟体の割合を調べるというものがあります。上述のように大腸菌は、外膜と細胞膜を有しており、これらの膜に挟まれたペリプラズムと呼ばれる空隙を持っています。β-ラクタマーゼ未成熟体は、FtsYが関わる膜透過機構とは別の機構で細胞膜を透過しペリプラズム空隙に輸送されますが、その輸送の際にペプチダーゼと呼ばれる酵素がβ-ラクタマーゼ未成熟体の構造の一部を切り取ることで、成熟体へと変化します。このペプチダーゼもペリプラズム空隙に存在する酵素であり、FtsYが関わる膜透過機構により細胞膜を透過し活性が現れることが知られています。これらの知見から、β-ラクタマーゼの成熟体と未成熟体の割合を調べることで、FtsYが機能しているかどうか、すなわちFtsYが細胞膜との結合能を持っているかどうかを調べることができます。
大腸菌完全長のftsY遺伝子、そして放線菌疎水性領域と大腸菌不完全長をつなげたftsY遺伝子をそれぞれ導入した大腸菌株ではほとんど未成熟体が蓄積していないのに対して、大腸菌不完全長のみのftsY遺伝子、そして放線菌親水性領域と大腸菌不完全長をつなげたftsY遺伝子をそれぞれ導入した大腸菌株では著しい未成熟体の蓄積が認められました(図)。この結果から、放線菌FtsY末端の疎水性領域が細胞膜との結合に関与することが明らかになりました。
これまでに海外の研究者らにより、大腸菌のFtsYでは、末端の親水性領域が細胞膜との相互作用に関与することが明らかになっています。グラム陽性細菌である放線菌とグラム陰性細菌である大腸菌においては細胞膜とFtsYの相互作用の様式が異なることが示唆されました。
今後の展望
タンパク質の細胞膜透過の機構は複数のタンパク質分子、RNA分子、細胞膜が関わる非常に複雑な過程から成ります。今回の放線菌FtsYタンパク質に関する研究成果を足掛かりにして、放線菌や枯草菌、乳酸菌等の産業上重要なグラム陽性細菌において、細胞膜透過機構の全容が解明されることが期待されます。上述のグラム陽性細菌は毒素も生産せず、それらの中には発酵食品の生産に用いられるほど安全なものも多種存在します。したがって、それらの機構を解明することで、将来的には大腸菌よりも安全に、安価で、かつ効率的に有用組み換えタンパク質の生産が可能になるかもしれません。
用語解説
疎水性と親水性:油に溶けやすい化学物質の性質を疎水性、逆に水に溶けやすい性質を親水性といいます。タンパク質はアミノ酸がペプチド結合により幾重にも連なった構造を取っていますが、ペプチドの主鎖に結合する官能基、すなわちペプチド残基の側鎖の物性により、タンパク質分子総体に、あるいはタンパク質の部分的領域に疎水性あるいは親水性の偏りが生じています。この疎水性あるいは親水性の偏りは、タンパク質に特定の機能や触媒活性を与える上での重要な要素です。
グラム陽性細菌とグラム陰性細菌:グラム染色と呼ばれる真性細菌の染色法で紫色に染まる細菌群をグラム陽性細菌、染まらない細菌群をグラム陰性細菌と呼びます。真性細菌を最も大きな枠で分類した際の呼称です。グラム染色はグラム陽性細菌とグラム陰性細菌の細胞壁の構成成分の違いを利用した染め分けの手法だと言うこともできます。
本件に関する問い合わせ先
宇都宮大学農学部 生物生産科学科・微生物工学教育研究分野(宇都宮大学バイオサイエンス教育研究センター 兼任)
准教授 前田 勇(まえだ いさむ)
Tel: 028-649-5477(研究室)